参照2020版GCP关于安全性信息报告的调整,现公布我院机构安全性信息收集流程。
1. 递交流程
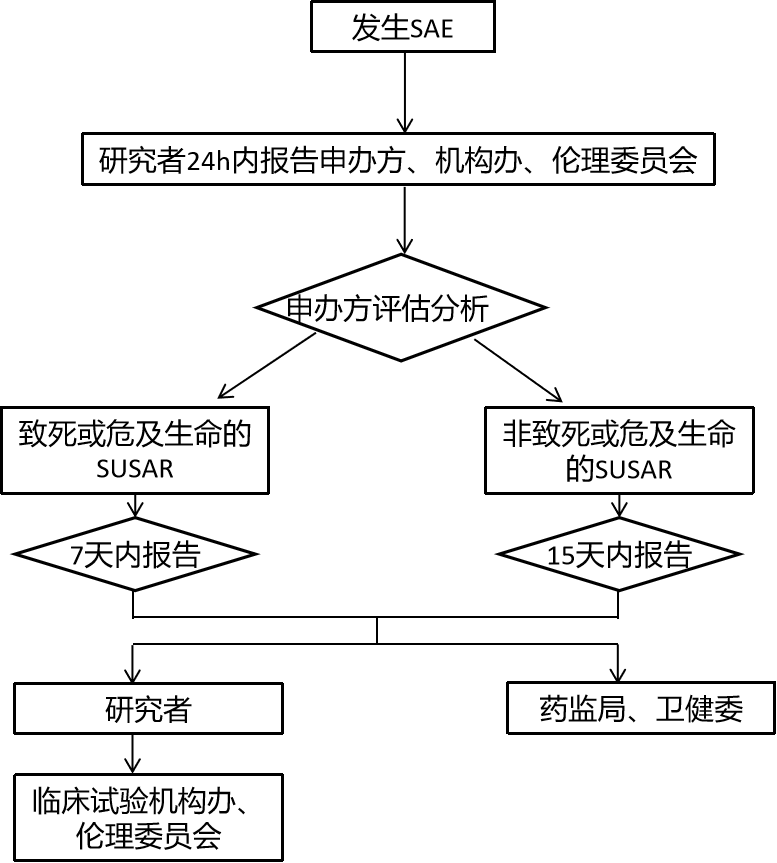
除试验方案或者其他文件(如研究者手册)中规定不需立即报告的SAE外,研究者在获知受试者出现SAE时,使用标准化SAE表格在24h内报告申办方、机构办和伦理委员会。申办方将评估为可疑且非预期严重不良反应(SUSAR)反馈给本中心研究者。研究者收到申办方提供的SUSAR报告后及时审阅签收,并向本院药物临床试验机构办公室递交由申办方提供的SUSAR报告。
2. 递交时限
除方案另有规定外,一般为24h。
所有SUSAR报告应当遵循7天和15天的快速报告要求,向本院药物临床试验机构提交SUSAR报告。即:
对于致死或危及生命的非预期严重不良反应,申办方应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息(申办方首次获知当天为第0天)。
对于非致死或危及生命的非预期严重不良反应,申办方应在首次获知后尽快报告,但不得超过15天。
3. 递交内容
1)SUSAR报告电子版
2)SUSAR列表(模板下载)
3)SUSAR报告递交信(研究者审阅签字PDF版)
将以上文件纸质版在一个月内递交机构办和伦理委员会存档。
4. 递交语言
SUSAR报告原则上应为简体中文。如为原始资料为英文版,可第一时间递交英文版报告,后续将中英文报告配合递交。
5. 递交方式
SUSAR报告表和SUSAR列表发送至机构邮箱(jigougcp_zy4y@163.com)和伦理邮箱(jigoulunli_zy4y@163.com)。邮件标题格式:项目编号+-SUSAR+-递交次数,举例:2020YW001-SUSAR-01。
6. DSUR报告要求
研究期间安全性更新报告至少1年提交一次。报告给研究者、机构办和伦理委员会。机构办和伦理递交邮箱同SUSAR报告邮箱,邮件标题格式:项目编号+-DSUR+-递交次数,举例:2020YW001-DSUR-01。
SAE/SUSAR提交流程
Copyright@ 2018. 版权所有 浙江大学医学院附属第四医院
 微信订阅号
微信订阅号
 微信服务号
微信服务号
 人民号
人民号
 视频号
视频号
 新浪微博
新浪微博
 抖音
抖音